一. 启动子
启动子是可以启动目的基因转录的DNA序列,该序列可以被RNA聚合酶所识别,并开始转录合成RNA。启动子可以和调控基因转录的转录因子产生相互作用,控制基因转录的起始时间和转录的强度,它就像 “开关”一样,决定基因的活跃程度,继而控制细胞开始生产哪一种蛋白质。目前绝大多数的基因治疗产品,都的是病毒启动子。这主要是还是从提高蛋白表达效率的角度出发,希望尽可能地利用少量的病毒去表达尽可能多的目标蛋白。而病毒的启动子往往是强的组成型启动子,他们可以在宿主细胞内,招募宿主的转录因子,达到比宿主启动子高得多的转录水平。并且在长期的进化中,病毒的基因组结构已经变得十分紧凑,长度较短,非常适合应用于基因治疗载体。
目前最常见的病毒启动子是人巨细胞病毒的早期启动子(CMV-IE promoter/ CMV promoter),在CMV中,这个启动子负责IE1 和 IE2 基因前体 RNA 的转录起始。最常用的是一个600-800bp的CMV enhancer/promoter/UTR的融合版本,它能够在许多的组织中达到一个高强度的转录水平。但也有报道称,CMV 启动子驱动的蛋白表达水平会随着培养时间的延长而降低,宿主细胞会提高DNA甲基化的水平,从而将CMV启动子的转录沉默掉。
还有一些人工组合的启动子(有些也融合了也包含了部分intron序列在里面)也利用了CMV的部分序列,例如CAG(C,the Cytomegalovirus early enhancer element;A,chicken beta-Actin promoter; G, splice acceptor of the rabbit beta-Globin gene)、CBh启动子等等。CAG启动子的全长大约有1.8kb,’’结构较为复杂,具有非常强的转录活性和广泛的宿主范围。但由于序列过长,因此在应用于AAV时,具有明显的局限性。于是一些实验室在这个基础上开发了类似的混合启动子,在缩小了启动子尺寸的同时,大体保证了它的转录活性。例如简化的CAG/CBA启动子,简化后的序列长度仅有584bp。除了这些常见的病毒启动子之外,还有很多管家基因的启动子,也被用于基因治疗当中。比较普遍的包括1.2kb 的EF1-α 启动子、500bp 的PGK 启动子以及UBC启动子等等,但是其转录能力,就要弱于CMV、CAG等高强度的启动子们。
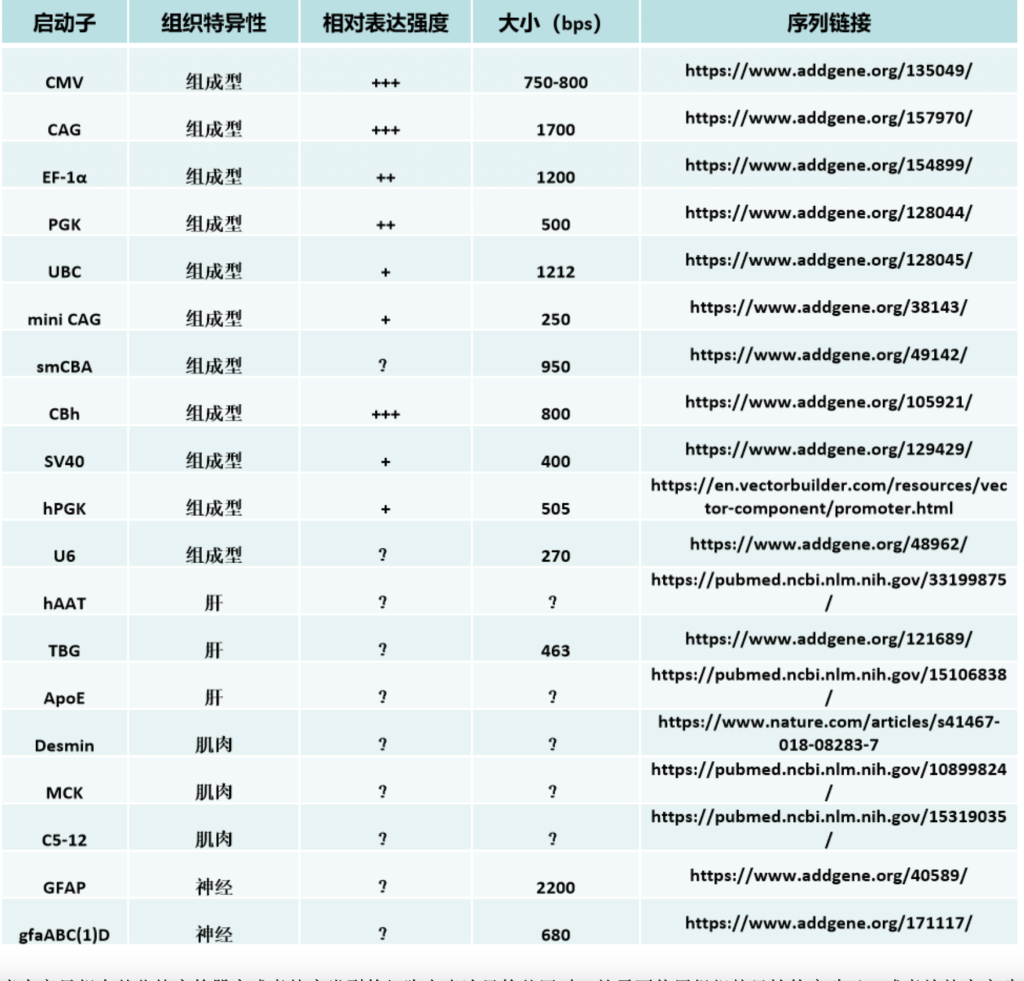
当大家只想在某些特定的器官或者特定类型的细胞内表达目的基因时,就需要使用组织特异性的启动子,或者给特定启动子加上一些组织特异性的调控原件。这样即使在载体没有特别好的靶向性的情况下,也可以限制目的基因在非靶标组织的表达泄露。例如胶质纤维酸性蛋白 (GFAP, 2.2 kbs) 启动子以及截短版本的gfaABC(1)D都被用来在星形胶质细胞中进行特异性的基因表达。此外还有在肌肉中常用的MCK,心肌中常用的cTNT,肝脏中常用的hAAT、ApoE等。但这些启动子也有很难克服的局限性:表达量低和尺寸较大。这是组织特异性表达需要给顺式作用元件提供大量的序列空间,因此其尺寸就必然要大于组成型启动子;另外组织特异性启动子需要被特定组织细胞内有限的反式作用因子所调控,即其所能被上调的峰值也是较低的。目前也有很多实验室通过生物信息学的方法来分析启动子及其调控原件的序列,精简或者串联多个不同来源的调控原件,以增强组特特异性表达的强度,也获得了一些喜人的突破。
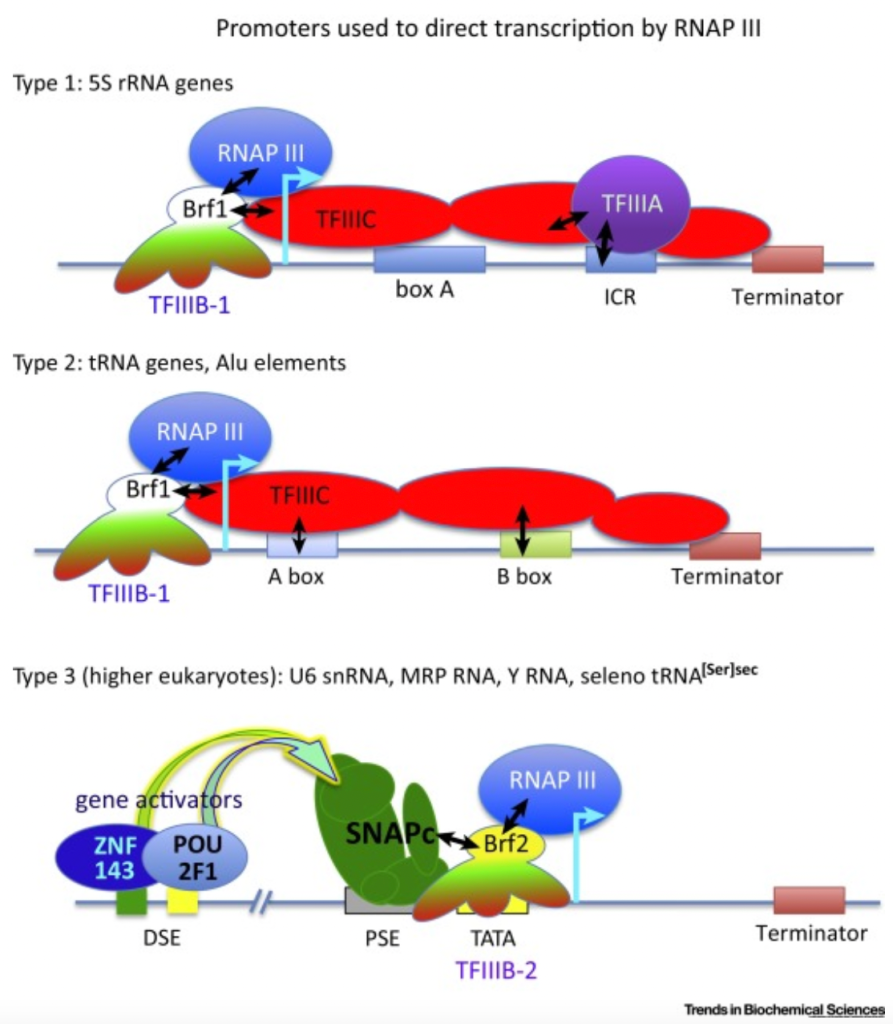
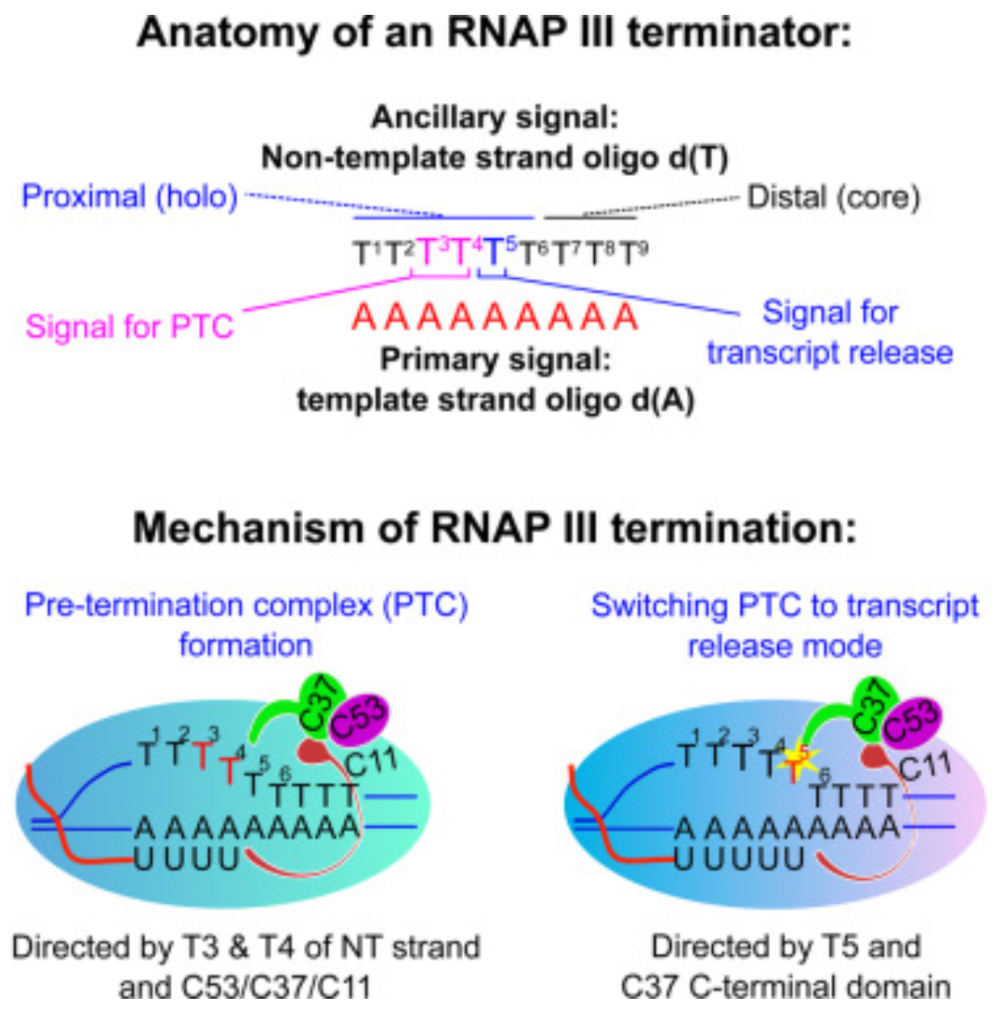
在真核细胞中,有三种不同的 RNA 聚合酶,即 RNA 聚合酶 I、II 和 III。RNA 聚合酶 I 合成了大多数的 rRNA, RNA 聚合酶 II 转录所有 mRNA 和许多非编码 RNA,RNA 聚合酶III 则转录了其他的小的非编码(5S rRNA, snRNAs, snoRNAs, SINEs, 7SL RNA, Y RNA, 以及 U6 spilceosomal RNA等等)。如上所述,用于目的基因表达的启动子都是结合RNA 聚合酶 II,但如果基于想在病患体内表达功能性RNA例如shRNA、miRNA、sgRNA等等,这个时候就需要用到结合RNA 聚合酶 III的 III型启动子,目前最常用的有小鼠的U6启动子和H1启动子。而在让目的mRNA转录终止时,通常使用 T-stretch 作为终止信号,但终止效率和实际终止位点也并不是一致的。其中T4 信号是最小的终止信号,但完整的转录终结只有在 T-stretch ≥6 时才能达到。如果没有达到完整的转录终结,可能会产生低水平的 3′ 延伸 RNA,进而会干扰下游基因的表达。因此,在设计小 RNA 表达盒中至少应使用可以实现完全 Pol III 终止的T6/7 信号。
二. 转录后调控原件
在表达外源基因时,将一些转录后调控原件插入到3′ 非翻译区,可以增加mRNA在细胞内的积累水平并提高翻译效率,这样也可以在一定程度上增加外源基因的表达量。目前比较常用的是乙型肝炎病毒的转录后调控元件 (HPRE) 和土拨鼠肝炎病毒的转录后调控元件 (WPRE)。它们都是嗜肝DNA病毒的顺式作用 RNA 元件,可以通过促进 mRNA 从细胞核输出到细胞质来增加mRNA在细胞质 内的积累,增强3’端加工效率和mRNA稳定性。通常,未经剪接的 mRNA 会以较低的效率运输到细胞质中,然而一些细胞因子可能与 PRE 元件相互作用并介导其转录后的转运(RNA在核仁中转录后,会经过快速的加工过程,去除翻译的间隔区,产生成熟的mRNA,这些mRNA可以与核糖体结合并在细胞质中大量积累 。虽然前体RNA 的半衰期非常短~mins,但成熟的mRNA在细胞质中的半衰期则会较长~days。因此,帮助mRNA从核仁到细胞质的运输,在一定程度上提高了细胞内mRNA的积累水平)。然而,尽管 HPRE 、WPRE 对基因表达有益,但它们的序列相当长(600 bp),因此只能用于其他表达元件尺寸很小的表达框中。
三. polyA加尾信号
终止子位于基因序列的3’末端,通常直接出现在3′ 调节元件之后,它可以将新合成的mRNA 从转录复合物中释放出来。虽然启动子强度是决定基因表达水平的主要因素,但终止子在 RNA 加工中也发挥着重要作用,它会直接改变RNA 的半衰期,并最终导致基因表达水平的改变。目前常用的终止子包括SV40、hGH、BGH 和rbGlob,他们在序列上都包括促进多聚腺苷酸化和终止的motif AAUAAA。mRNA的转录终止和多聚腺苷酸化是一个协同过程,mRNA会在polyA加尾信号AAUAAA与下游的GU-Rich区之间发生切割,从而产生一个游离的 3′ 末端并用于在此基础之上进行polyA加尾。
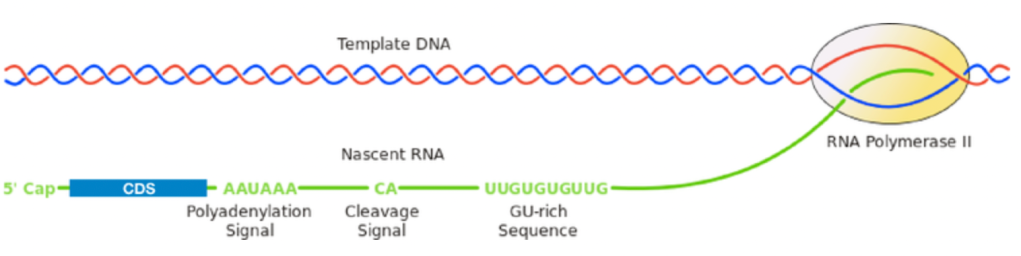
四. 多顺反子载体—-一根藤上七个瓜
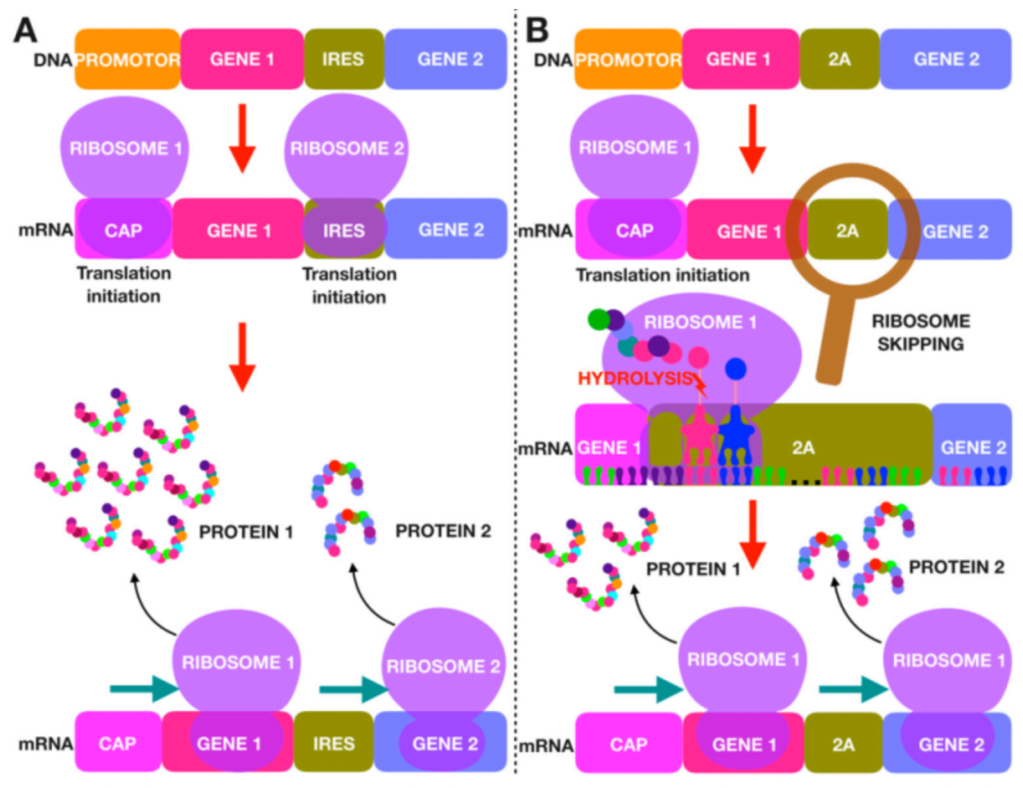
人类大多数的疾病并不是简单的单基因病,在治疗时,科研人员往往需要同时给与患者多种蛋白分子进行共同作用,因此基因治疗还要面对需要同时递送和表达几个目的蛋白的挑战。将多个基因克隆到一个载体中,从而进行多个基因的联合表达会在一定程度上提高基因治疗的有效性。目前常用的策略是在表达框中加入内部核糖体结合位点IRES或者加入有自切割功能的2A Peptides。
大多数情况下,真核生物的翻译起始需要mRNA的5’帽子与核糖体的小 (40S) 亚基以及许多翻译起始因子 (eIF) 相结合。而IRES 序列可以控制不依赖于5’帽子的蛋白质合成。IRES 序列大多是在病毒中发现的 ,大小多长于500 bp,目前最常用的是EMCV 和MSCV的IRES。
2A 肽是源自病毒的短肽 (~18-25 aa)。它们具有自我切割的功能,可以从同一个转录本中表达出多种蛋白质。但实际上,2A 肽的自我切割,并不是完整的把2A多肽切割下来,甚至它就不是真正的对翻译好的肽链进行切割。以源自口蹄疫病毒的2A 肽F2A为例-(GSG) VKQTLNFDLLKLAGDVESNPG P,F2A的功能是使核糖体跳过2A 肽 C 末端甘氨酸G和脯氨酸P之间肽键的合成,从而导致 2A 肽末端和下游肽段分离成两条多肽。因此,上游蛋白的 C 末端会添加额外的 2A 残基即(GSG) VKQTLNFDLLKLAGDVESNPG,而下游蛋白的 N 末端会添加额外的一个脯氨酸P。目前常用的2A肽有四种,P2A、T2A、E2A 和 F2A,它们来自于四种不同的病毒。
IRES 的主要缺点是两段蛋白的表达水平不一致,与多顺反子中的上游 ORF 相比,IRES 下游ORF 的表达水平会低很多(通常为上游表达水平的 10-20%)。IRES 元件也可能由于其尺寸(>500 bp)的问题,增加病毒包装的难度。2A 肽的缺点则是两个ORF 上留下的2A肽残基可能会影响目的蛋白的活性。此外,2A 肽的自切割不是 100% 有效的,并且切割效率会受到上下游 ORF 序列的强烈影响。因此,来自多顺反子的大部分翻译产物可能是未能自切割的融合蛋白,这在很多的应用中会是一个重要问题。在四种常用的 2A 肽中,P2A 通常具有最高的切割效率。接下来是 T2A,然后是 E2A 和 F2A。F2A的裂解效率仅为50%左右。
五. 表达框内的其他元素—-内含子与UTRs等
内含子的存在,可以影响包括转录、多聚腺苷酸化、mRNA 输出、翻译效率和 mRNA 降解在内的基因表达的各个步骤。然而前体RNA的剪接其实是一个非常耗能的步骤,剪接体内含子的切除需要在复杂剪接体的帮助下才能完成剪接过程(剪接体甚至是细胞中最大的分子复合物之一)。因此在长期的进化中,内含子的存在对细胞是有巨大负荷的。内含子对生物真正的意义,还有待于人们去发掘。而在设计基因表达框时,引入一些特别的真核生物内含子可以增加目的基因的表达量,这些内含子在转录起始位点的下游发挥作用。另外mRNA 的非翻译区 (UTR) 内存在多个调控元件,这对于 mRNA 的稳定性和蛋白翻译的效率也是非常重要的。譬如说 β-珠蛋白的5′-和 3′-UTR 可以明显提高翻译效率, α-珠蛋白的 3′-UTR则可以稳定mRNA,非洲爪蟾 β-珠蛋白 5′- 和 3′- UTR 、TEV的5′-UTR和人热休克蛋白 70 的 5′-UTR等同样被发现可以提高mRNA 的翻译效率等等。另外,在有些研究中,与内源性 miRNA 互补的靶序列也被整合到了表达盒里,这样可以起到在特定miRNA高表达的组织中“de-target”或抑制转基因表达的作用。
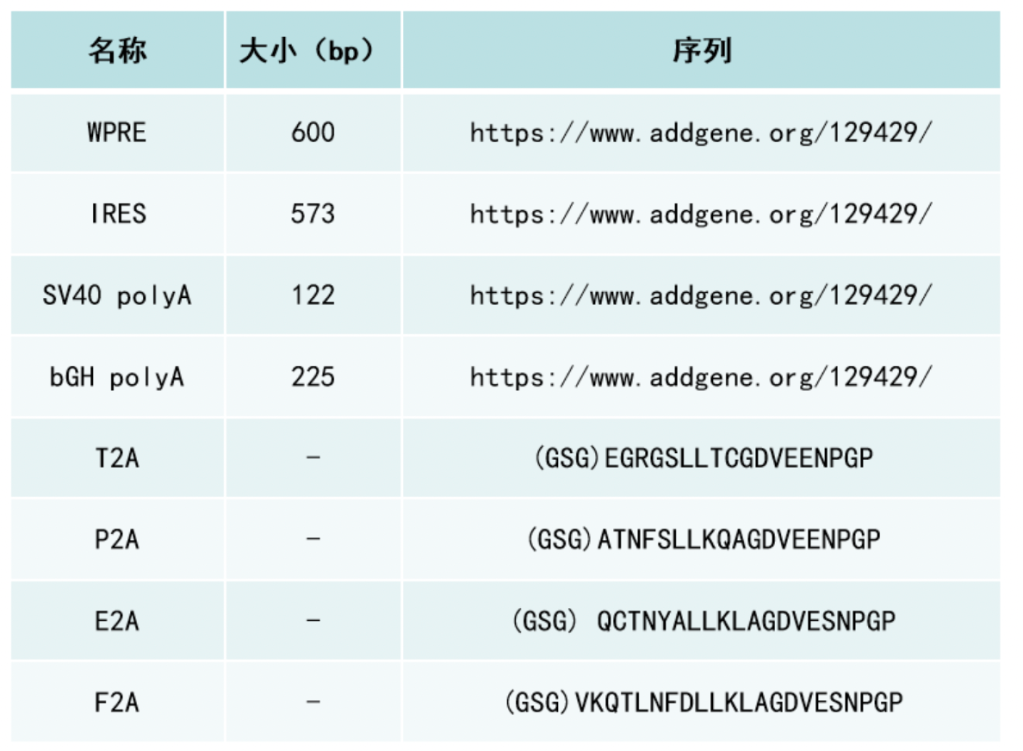
* (GSG) 残基可以添加到肽的 5′ 末端以提高切割效率
设计一个合格的基因表达框是一份可以很简单但又可以很复杂的工作,对不同组件的挑选、组合与改造,将会决定外源基因在目标组织中的表达量与表达时间。而AAV较小的外源基因承载空间,则给研究人员的发挥限制在了一个较小的舞台。如何在螺蛳壳里做道场,还是要靠科研人员针对不同的外源基因、靶组织进行case-by-case的尝试,这样才能开发出优质的表达框。
此外,所有蛋白表达框DNA序列都不是孤立的,必须构建到质粒骨架上(如AAV载体),与质粒骨架组成一个完整的闭环质粒,这对于DNA长期稳定的保存及后续的扩增生产都是至关重要的。